Surveillance hémo- dynamique

Surveillance hémodynamique
Les patients qui doivent être hospitalisés pour COVID-19 courent un risque plus élevé de développer des pathologies telles que la septicémie, les lésions pulmonaires aiguës (ALI) et le syndrome de détresse respiratoire aiguë (ARDS).1
L’instabilité hémodynamique est un facteur clé de la mortalité chez les patients atteints d’ARDS, et « la gestion réussie de l’hémodynamique complexe du patient ventilé atteint de SDRA est essentielle à la survie du patient »2. La majorité des patients nécessitant un traitement en USI auront besoin d’une ventilation mécanique.3 Les preuves existantes démontrent que les patients gravement malades qui développent ces complications sont susceptibles de développer un syndrome de dysfonctionnement multiple des organes (MODS), ce qui diminue considérablement les chances de survie du patient, augmente l’utilisation des ressources limitées de l’unité de soins intensifs et de l’hôpital et, en fin de compte, prolonge la durée du séjour dans l’unité de soins intensifs et à l’hôpital.4,5
Quatre phases du traitement hémodynamique en relation avec l’équilibre hydrique cumulatif6
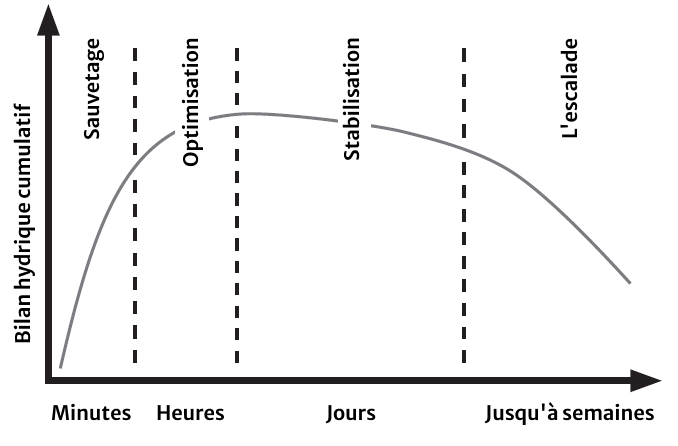
L’évolution rapide et la nature complexe des patients en phase critique nécessitent des renseignements continus pour aider à guider le patient tout au long du parcours de soins, indépendamment de la stratégie choisie en matière de gestion. La surveillance hémodynamique peut aider les cliniciens à traiter les patients gravement malades en leur fournissant des informations au cours des quatre phases de la maladie grave : sauvetage, optimisation, stabilisation et désescalade. Les modalités et les objectifs des soins varient considérablement au fur et à mesure que le patient progresse dans le continuum des soins.6
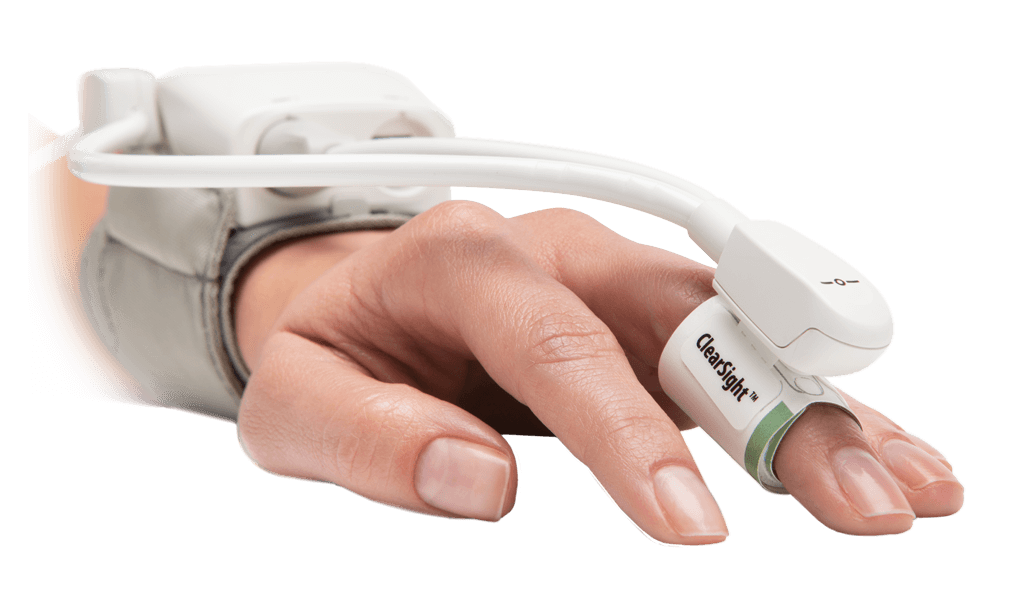
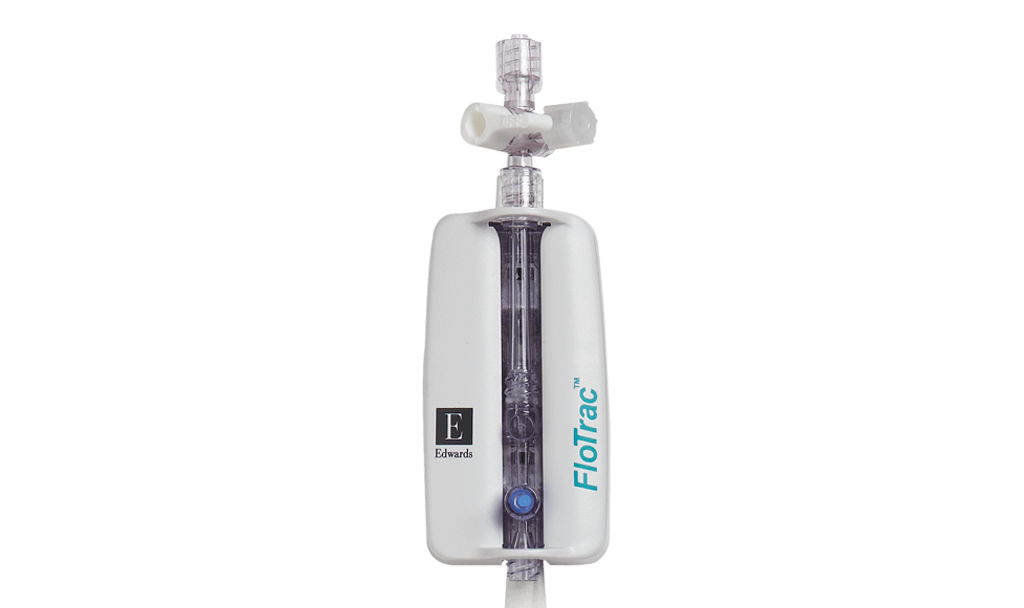
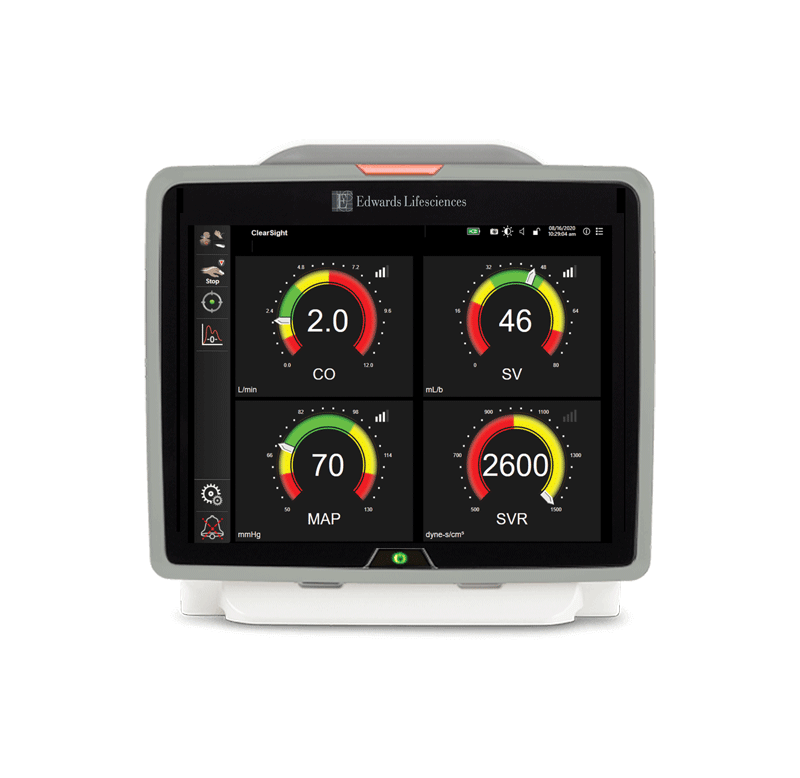
L’utilisation de la surveillance hémodynamique pendant la phase de sauvetage comprend des outils de base pour surveiller le patient dans les premières minutes ou heures de soins. La surveillance continue et non invasive de la pression (y compris le manchon de doigt ClearSight) peut contribuer à la gestion de l’hypotension et jouer un rôle dans la détection précoce de la septicémie, du choc septique et d’autres états de choc. La surveillance invasive de la pression à l’aide de capteurs de pression jetables (y compris les transducteurs de pression TruWave) facilite la gestion de l’hypotension et permet d’accéder aux diagnostics initiaux, tels que les gaz du sang et d’autres examens de laboratoire. Outre la pression artérielle continue, il est possible d’obtenir des paramètres dynamiques et basés sur le débit, tels que le débit cardiaque (CO), le volume systolique (SV) et la variation du volume systolique (SVV) (p. ex., le capteur FloTrac/le manchon de doigt ClearSight) afin de mieux comprendre le traitement de réanimation liquidienne que les paramètres basés sur la pression artérielle.3,6,7
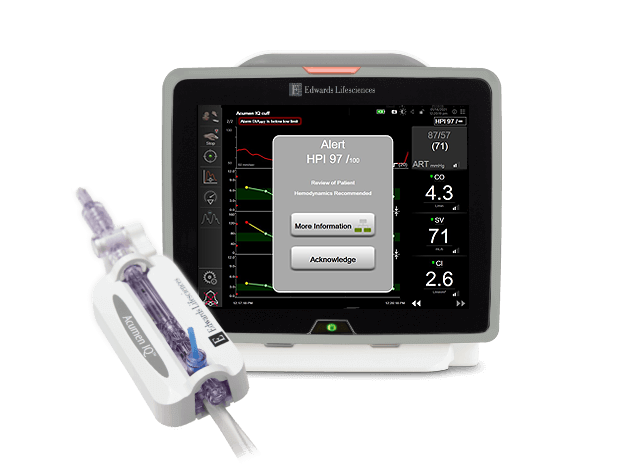
Les paramètres dynamiques peuvent aider à identifier le traitement initial le plus approprié, par exemple en aidant les cliniciens à décider entre l’administration de volume et l’initiation de vasopresseurs. En outre, les paramètres hémodynamiques avancés fournissent des informations précieuses sur l’adéquation de la perfusion, car la pression artérielle peut être préservée malgré la présence d’une perfusion tissulaire inadéquate.7 Les nouvelles technologies prédictives (logiciel Acumen Hypotension Prediction Index) peuvent désormais prédire de manière fiable l’instabilité hémodynamique qui conduit à l’hypotension.8
La phase d’optimisation est limitée dans le temps (généralement jusqu’aux premières 24 heures) avec pour objectif d’atteindre une perfusion optimale des tissus périphériques et de rembourser toute dette d’oxygène contractée au cours de la maladie.6 L’utilisation systématique de lignes artérielles et de cathéters veineux centraux est courante chez les patients nécessitant une ventilation et est recommandée pour les traitements nécessitant des vasopresseurs.7 Les vasopresseurs ou les inotropes ne doivent être mis en place que lorsqu’un apport liquidien approprié n’a pas permis de rétablir la perfusion de l’organe.6
Équilibre entre l’apport et la consommation d’oxygène9
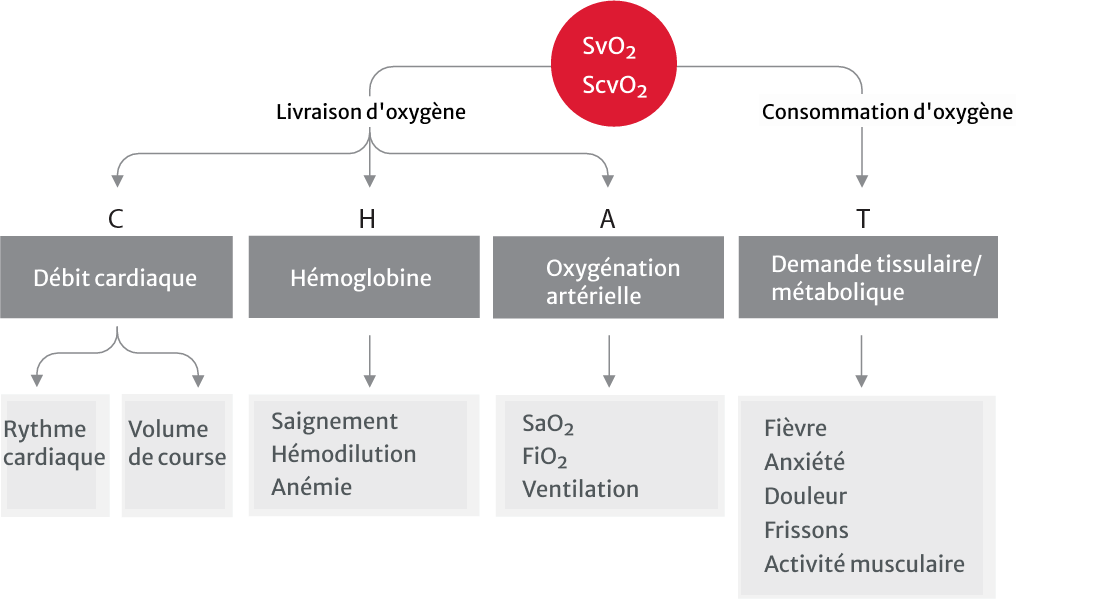
Le monitorage du débit cardiaque et du volume systolique est recommandé pour évaluer la réponse individuelle du patient aux fluides, aux vasopresseurs ou aux inotropes.7 Un monitorage plus invasif, tel que le cathéter d’artère pulmonaire de Swan-Ganz, est indiqué chez les patients plus complexes tels que les patients présentant un choc réfractaire, un SDRA et un dysfonctionnement du ventricule droit.7 Ces dispositifs fournissent des paramètres supplémentaires tels que les pressions cardiaques droites, l’oxymétrie veineuse mixte continue (SvO2) et des paramètres volumétriques tels que la fraction d’éjection du ventricule droit (FEVD) et le volume ventriculaire droit en fin de diastole (VVDD).
La surveillance hémodynamique peut apporter une valeur ajoutée à cette phase des soins, car elle permet une évaluation séquentielle du patient9 et de sa réponse individuelle aux thérapies.7 Cela peut contribuer à l’identification précoce des complications en développement telles que la dysfonction cardiaque et/ou les états de faible débit qui peuvent survenir.7 Par exemple, les patients atteints d’ARDS sont couramment pris en charge avec des stratégies qui peuvent avoir un impact négatif sur l’hémodynamique du patient.1 Une gestion restrictive ou conservatrice des fluides peut entraîner une perfusion tissulaire inadéquate.10
Le déséquilibre des fluides entraîne des complications10
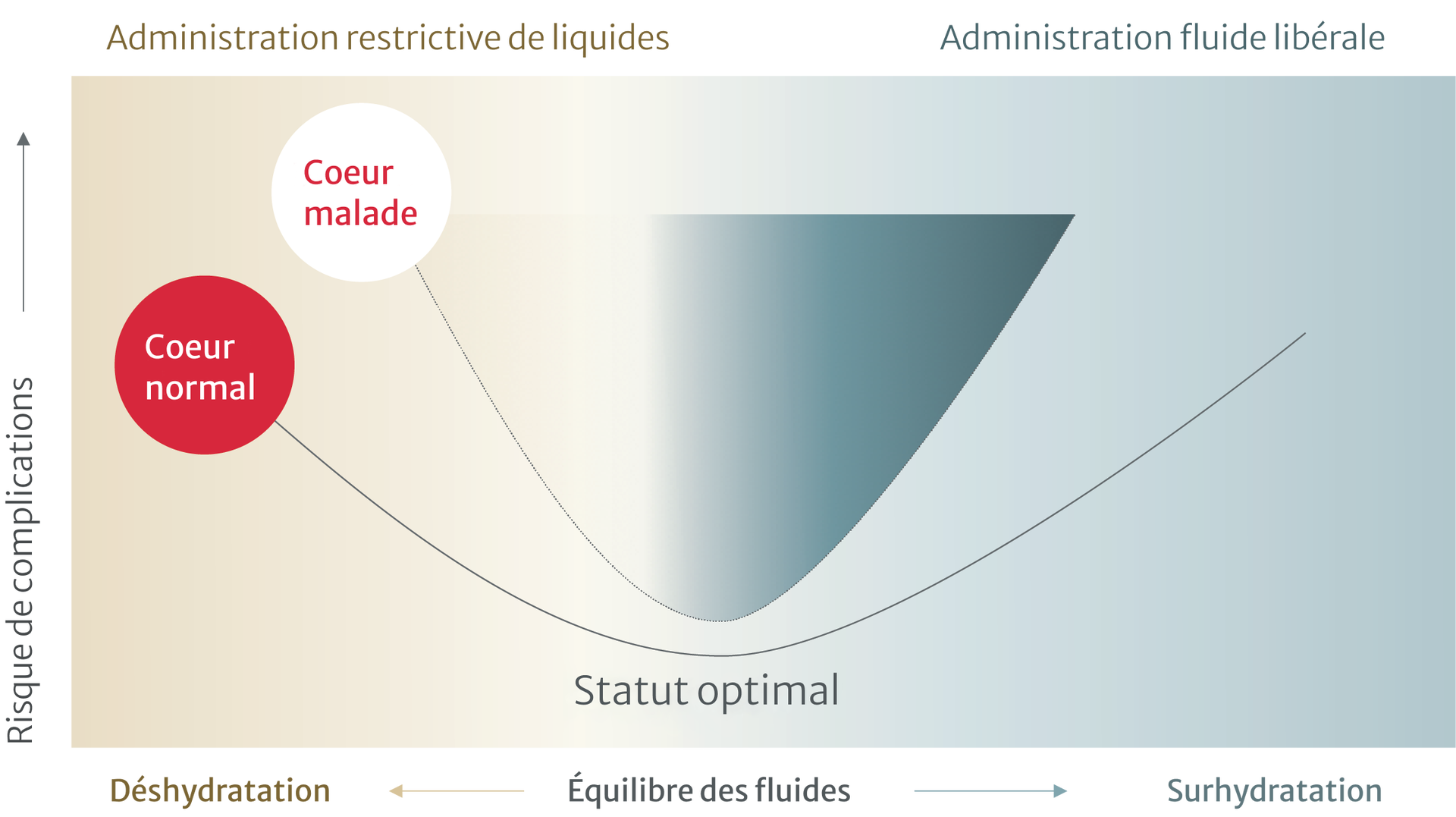
L’utilisation de paramètres dynamiques permettra d’identifier une perfusion tissulaire inadéquate lorsqu’elle se produit et aidera les cliniciens à vérifier si l’administration de liquide améliore le flux sanguin. De même, ces paramètres peuvent aider à limiter l’administration excessive de liquide lorsqu’aucune amélioration du flux sanguin n’est associée à l’administration de liquide.11
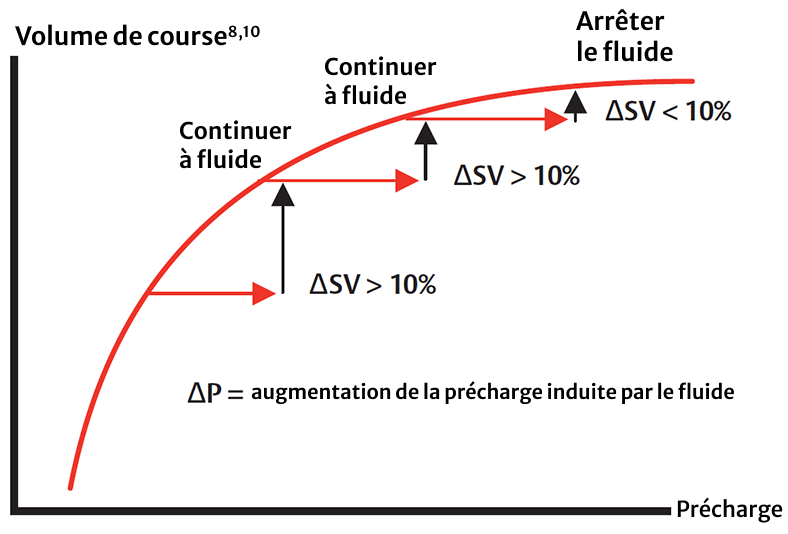
Certaines thérapies utilisées pour prendre en charge les patients gravement malades peuvent contribuer à une perfusion inadéquate. Par exemple, l’utilisation d’une ventilation à PEEP élevée est courante, et la pression intrathoracique excessive créée peut avoir un impact négatif sur la fonction ventriculaire droite.2 Les patients nécessitant des doses élevées de vasopresseurs pour maintenir une PAM adéquate peuvent avoir un impact négatif sur le SV et le CO. De même, les changements de position du patient (comme la thérapie en décubitus ventral) peuvent avoir un impact négatif sur la circulation sanguine.2 D’autres thérapies visant à améliorer l’oxygénation, telles que les vasodilatateurs inhalés, peuvent également modifier de manière significative l’hémodynamique du patient.2
Enfin, pour les patients les plus gravement malades, la surveillance de l’oxymétrie tissulaire (par exemple avec le capteur ForeSight) peut contribuer à l’identification précoce des désaturations cérébrales.12,13
Au fur et à mesure que le patient passe par les phases de stabilisation et de désescalade, les soins passent d’une réanimation agressive à un état de guérison. La surveillance hémodynamique fournit des données continues sur la réponse du patient pendant le sevrage des thérapies telles que la ventilation mécanique, les médicaments vasoactifs et l’élimination des liquides pour réduire toute balance hydrique positive.6 En outre, la surveillance hémodynamique peut permettre une reconnaissance précoce des complications en cours de développement telles que la septicémie, le développement d’un dysfonctionnement cardiaque et l’hypotension.
En résumé, la surveillance hémodynamique avancée est considérée comme un élément essentiel dans un grand nombre de directives, de recommandations et de normes de soins pour les patients gravement malades.1,2,3,6,7
Références
- World Health Organization Clinical management of severe acute respiratory infection (SARI) when COVID-19 disease is suspected: Interim guidance V 1.2
- Viellard-Baron, et al. Experts’ opinion on management of hemodynamics in ARDS patients: focus on the effects of mechanical ventilation. Intensive Care Medicine (2016)
- Alhazzani, et al. Surviving Sepsis Campaign: Guidelines on the Management of Critically Ill Adults with Coronavirus Disease 2019 (COVID-19). European Society of Intensive Care Medicine and the Society of Critical Care Medicine (2020)
- Vincent & De Backer. Circulatory Shock. New England Journal of Medicine. 2013. 1726-1734.
- Paoli, et al. Epidemiology and Costs of Sepsis in the United States—An Analysis Based on Timing of Diagnosis and Severity Level. Critical Care Medicine Journal. Décembre 2018, Volume 46, Numéro 12
- Benes et al. Fluid Therapy: Double Edged Sword during Critical Care. BioMed Research International (2015).
- Cecconi et al. Consensus on circulatory shock and hemodynamic monitoring. Task force of the European Society of Intensive Care Medicine. (2014)
- Cannesson, et al. Machine-learning Algorithm to Predict Hypotension Based on High-fidelity Arterial Pressure Waveform Analysis. Anesthesiology (2018)
- Nebout, et al. Should We Monitor ScVO2in Critically Ill Patients? Cardiology Research and Practice (2012)
- Bellamy MC. Editorial: Wet, dry or something else? British Journal of Anaesthesia (2006)
- Lopes MR, et al. Goal-directed fluid management based on pulse pressure variation monitoring during high-risk surgery: a pilot randomized controlled trial. Critical Care. (2007)
- Steffen, et al. Using Near-Infrared Spectroscopy to Monitor Lower Extremities in Patients on Venoarterial Extracorporeal Membrane Oxygenation Annals of Thoracic Surgery (2014)
- Wong, et al. Cerebral and Lower Limb near-Infrared Spectroscopy in Adults on Extracorporeal Membrane Oxygenation Department of Surgery Faculty Papers. Paper 76. (2012) http://jdc.jefferson.edu/surgeryfp/76